> Approche diagnostique des crises épileptiformes chez le jeune
Saint Priest France
I- Introduction
Les crises épileptiformes de l'animal jeune soulèvent des considérations différentes de l’adulte concernant l’étiologie, l'approche diagnostique et la prise en charge thérapeutique. Chez le jeune, certaines affections telles que les malformations congénitales ou les pathologies infectieuses sont plus fréquemment rencontrées. Comme chez l'adulte, la démarche diagnostique des crises débute par une anamnèse rigoureuse et un examen clinique complet. Ensuite, un bilan sanguin exhaustif doit être réalisé pour chaque patient. Une imagerie cérébrale souvent couplée à une ponction du liquide cérébrospinal (LCS) sera nécessaire pour investiguer les causes intracrâniennes. Dans certains cas, la recherche d’une mutation génétique permettra d’aboutir à un diagnostic définitif.
II- Anamnèse, examen clinique et neurologique
Une anamnèse rigoureuse et un examen clinique complet doivent précéder tout examen diagnostique. En effet, de nombreuses affections responsables de crises chez le jeune ont des répercussions systémiques (maladie de Carré, cryptococcose, péritonite infectieuse féline, shunt portosystémique, …).
Les crises dites réactives se caractérisent par des troubles nerveux le plus souvent intermittents : prostration passagère, désorientation, salivation, tremblements, … Des signes généraux sont parfois observés tels que des signes digestifs (diarrhée chronique), une dysurie, un retard de croissance, un amaigrissement, …En cas de lésion structurelle cérébrale, l’examen inter-ictal est souvent anormal : démarche en cercle, déficits proprioceptifs, déficit visuel ou encore déficit sensitif facial.
III- Investigations extra-crâniennes
Pour chaque jeune patient présentant des crises, le bilan sanguin doit inclure :
- une biochimie complète incluant un ionogramme (Gly, Urée, Créat, PAL, ALAT, PT, Alb, Glob, Chol, TG, Na, Cl, K, Ca) ;
- une numération / formule sanguine (NFS)- Dosage des acides biliaires pré (T0) et postprandiaux (T + 2h) ;
- une analyse d’urine avec densité, bandelette et analyse du culot doit également être réalisée. On recherchera notamment : une hyposthénurie (diabète insipide central), des cristaux d’urate (shunt porto-systémique), une protéinurie (malabsorption de la vitamine B12) ou encore une infection urinaire (bactériémie responsable d’un empyème intracrânien).
Selon la suspicion clinique, d’autres examens peuvent s’avérer nécessaire.
1. Shunt porto-systémique
Une hypoalbuminémie et une diminution de l’urée sont fréquemment notées. Une hypocholestérolémie, une hypoglycémie et une élévation des paramètres hépatiques peuvent également être observées. La NFS révèle souvent une microcytose. Les acides biliaires pré et postprandiaux sont augmentés dans plus de 95% des cas pour les shunts extrahépatiques. Une hyperammoniémie est fréquemment observée. La sensibilité et la spécificité du NH3 est d’environ 80%. Pour les acides biliaires, la sensibilité est de 93% chez le chien, 100% chez le chat ; la spécificité d’environ 70%. A l’analyse d’urine, des calculs de biurate d’ammonium sont parfois notés. Une échographie abdominale permet de visualiser et de localiser le shunt dans la majorité des cas. D’autres signes échographiques peuvent également être notés tels qu’une microhépatie, une néphromégalie ou encore la présence de calculs vésicaux. Lorsqu’un doute persiste après l’échographie abdominale, un angioscanner est parfois nécessaire afin de visualiser et d’identifier la localisation exacte du shunt avant d’envisager une intervention chirurgicale.
2. Malabsorption sélective de la vitamine B12
En cas de diarrhée intermittente, retard de croissance ou dysorexie, un bilan d’absorption (TLI, folates, vitamine B12) peut se révéler intéressant. Certaines races (Border Collie, Berger australien, Beagle) sont prédisposées génétiquement à des déficits en cobalamine. Le bilan sanguin montrera une hypocobalaminémie parfois associée à une hyperammoniémie, une hypoglycémie, une anémie et une neutropénie. Des tests génétiques sont disponibles dans le commerce pour appuyer le diagnostic (cf. tableau 1).
3. Néosporose
La créatine kinase (CK) et l’asparte aminotransférase (ASAT) sont significativement augmentées chez la majorité des chiens atteints de néosporose.
4. Dyskinésie paroxystique (Border Terrier)
Le diagnostic s’appuie sur le dosage sérologique de la transglutaminase-2 et des anticorps anti-gliadine (IgA et IgG).
IV- Diagnostic des causes intra-crâniennes
L’examen de choix pour investiguer l'anatomie de l'encéphale est l’Imagerie par Résonance Magnétique (IRM). En effet, cette modalité d’imagerie est nettement plus sensible que la tomodensitométrie (scanner) pour distinguer les différentes structures anatomiques du cerveau.
L’IRM cérébrale est particulièrement indiquée si :
- âge < 6 mois Examen neurologique inter-ictal compatible avec la présence d’une anomalie intracrânienne ;
- crises groupées ou status épilepticus ;
- résistance à un traitement antiépileptique correctement dosé.
La ponction du LCS permettra de caractériser une maladie inflammatoire du système nerveux central (SNC), de rechercher des agents infectieux et parfois de visualiser directement des cellules tumorales. Le LCS est analysé via un comptage cellulaire, une cytologie et une mesure du taux protéique (protéinorachie). Des analyses sérologiques et PCR peuvent être proposées selon la présentation clinique et les images IRM. Dans certains cas, le LCR peut être mis en culture.
1. Anomalies congénitales
-
Hydrocéphalie : le diagnostic peut être fait via une IRM ou un scanner. L’IRM est de qualité supérieure pour évaluer les tissus mous, le système ventriculaire et le tronc cérébral et permettra d’écarter des causes d’hydrocéphalie secondaire. Une échographie transfontanellaire peut aussi être utile.
-
Lissencéphalie : souvent rapportée chez Lhassa Apso. A l’IRM, la surface du cortex cérébral apparait lisse, compte tenu de l’absence de développement des circonvolutions. Le cortex cérébral est plus épaissi que la normale. Le corps calleux et la capsule interne sont fusionnés car la corona radiata (matière blanche) est absente.
-
Porencéphalie : l’imagerie cérébrale montre la présence d’une cavité intracérébrale circonscrite remplie de LCS.
-
Méningoencéphalocèle : une portion de tissu cérébral et les méninges font protrusion au travers d’un défaut osseux du crâne. Une porencéphalie est parfois associée.
-
Anomalies du corps calleux : l’IRM montre une agénésie ou une hypoplasie du corps calleux associées à un développement anormal du cortex avec notamment une fusion des lobes frontaux ventralement et d’une partie du diencéphale (holoprosencéphalie). Une hypernatrémie est fréquemment constatée au bilan sanguin.
2. Maladies inflammatoires
-
Péritonite Infectieuse féline (PIF) : la forme nerveuse de la PIF peut s’exprimer sous forme de différents syndromes. A l’IRM, les principales anomalies identifiées sont : une prise de contraste des méninges et de l’épendyme, une ventriculomégalie, de la syringomyélie, une hernie cérébelleuse. Le LCS montre dans près de 100% des cas une protéinorachie et un comptage cellulaire nettement augmenté. Une RT-PCR sur LCS pour le coronavirus a une spécificité de 100% et une sensibilité élevée de 85% pour les formes nerveuses. Les anomalies sanguines (hyperglobulinémie) sont possibles mais pas systématiques.
-
Toxoplasmose et néosporose : les lésions cérébrales peuvent être focales ou multifocales. Une atrophie bilatérale symétrique du cervelet est souvent constatée lors de néosporose. L’analyse du LCS peut mettre en évidence une pléiocytose mixte ou mononucléaire. Des tachyzoïtes peuvent être identifiés dans les cellules du LCS. Une recherche PCR sur LCS permet de confirmer le diagnostic.
-
Maladie de Carré : une pléïocytose mononucléaire est souvent observée dans le LCS. La sérologie sanguine n’est pas toujours pertinente car l’animal a souvent été vacciné préalablement. Un test PCR réalisé sur le LCS, le sang, les conjonctives ou les urines est la méthode diagnostique la plus fiable. Attention, le virus du vaccin peut être identifié pendant plusieurs jours suivant la vaccination.
-
Cryptococcose : le test d’agglutination au latex est très sensible et spécifique pour détecter les antigènes de Cryptococcus neoformans ou Cryptococcus gatii dans le sang ou le LCS. Des spores de Cryptococcus peuvent également être directement visualisées à la cytologie du LCS. Les images IRM sont variables. Des lésions de pseudokystes peuvent être visualisées. Parfois, un réhaussement des méninges, de l’épendyme ou des plexus choroïdes est noté.
-
Méningoencéphalites bactériennes : le LCS montrera le plus souvent une leucocytose neutrophilique. L’IRM peut permettre d’identifier une réhaussement méningé, la formation d’un abcès ou une otite moyenne-interne à l’origine du processus infectieux. Une culture du LCS ou des urines peut s’avérer utile pour identifier le germe. La visualisation de bactéries dans le LCS permet un diagnostic définitif.
-
Méningoencéphalites d’origine inconnue : un diagnostic présomptif peut être établi grâce à la combinaison des images IRM et d’une analyse du LCS. Les analyses sanguines sont en général normales. L’IRM montre des lésions focales ou multifocales, asymétriques, granulomateuses ou nécrosantes, le plus souvent hyperintenses en T2 et FLAIR, iso à hypointenses en T1 avec une prise de contraste variable. Le LCS montre le plus souvent une pléïocytose mononucléaire ou mixte. Le diagnostic définitif nécessite une histopathologie.
3. Tumeurs intracrâniennes
Les tumeurs neuroectodermiques primitives centrales se présentent sous forme de masses intra-axiales, situées à n’importe quelle localisation du SNC avec une extension extracrânienne possible. Les lymphomes peuvent avoir un aspect très variable, uni ou multifocal, intra ou extra-axial. Les méninges sont fréquemment anormales (épaississement, réhaussement ou signe de queue durale).
V- Tests génétiques
De nombreuses maladies génétiques du SNC ont été décrites ces dernières années en médecine canine. Ce groupe de maladies inclut les maladies de surcharge lysosomales, les aciduries organiques, les dégénérescences spongieuses, … Des tests génétiques sont disponibles pour de nombreuses mutations (cf. tableau 1). Par ailleurs, un déterminisme héréditaire est fortement suspecté pour de nombreuses races. Une mutation du gène LGI2 sur le chromosome 3 a été identifiée à l’origine d’une épilepsie juvénile génétique chez le Lagotto Romagnolo. Les Rhodesian Ridgeback peuvent présenter une forme juvénile d'épilepsie mycoclonique secondairement à une mutation sur le gène DIRAS1.
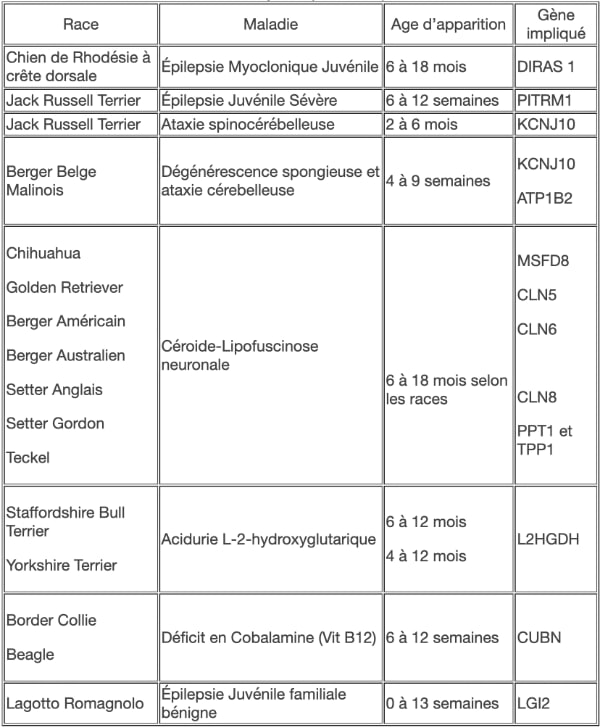
Tableau 1 - Principales affections génétiques responsables de crises épileptiformes chez le jeune (< 18 mois)
Bibliographie
- Arrol L et coll. Aetiology and long-term outcome of juvenile epilepsy in 136 dogs. Vet Rec. 2012 ; 170 : 335.
- De Risio L et coll. International veterinary epilepsy task force consensus proposal: diagnostic approach to epilepsy in dogs. BMC Vet Res. 2015 ; 11 : 148.
- Lavely J.A. Pediatric Seizure Disorders in Dogs and Cats. Vet Clin Small Anim. 2014 ; 44 : 275–301
> Et si ce n'était pas de l'épilepsie idiopathique ?
Paris France
Définition
L’épilepsie est définie comme une répétition de manifestations épileptiformes complexes généralisées (convulsions) ou simples partielles motrices, autonomiques ou comportementales (crises focales). Elle est très souvent d’origine indéterminée (qualifiée d’ idiopathique en médecine vétérinaire), secondaire à un abaissement du seuil d’excitabilité de tout ou partie du cortex ou des noyaux hémisphériques. Elle est assez bien connue des propriétaires, même s’ils en comprennent rarement l’étiopathogénie. Ils sont, en revanche, souvent surpris quand le clinicien énumère des causes lésionnelles intracrâniennes (épilepsie structurelle) ou des anomalies métaboliques ou toxiques (épilepsie réactionnelle) comme pouvant être à l’origine des crises de leur animal. C’est pourtant la raison pour laquelle des examens complémentaires (imagerie en coupe, examens sanguin, ponction rachidienne) sont nécessaires afin d’écarter ces causes multiples pour en arriver à un diagnostic d’épilepsie idiopathique avant d’instaurer un traitement uniquement symptomatique antiépileptique.
Epilepsie structurelle
L’épilepsie structurelle, à rechercher systématiquement si les crises sont présentes avant l’âge de 6 mois et après l’âge de 6 ans ou à tout âge si des déficits nerveux sont présents entres les crises (tendance à tourner, déficits visuels ou propriocetifs, changements comportementaux) est secondaire à la présence d’une lésion hémisphérique dont la nature peut être :
- vasculaire, traumatique ou spontanée (ischémique ou hémorragique) ;
- inflammatoire, infectieuse ou dysimmunitaire ;
- secondaire à une anomalie congénitale, isolée ou génétique, macroscopique ou microscopique ;
- néoplasique, primitive ou secondaire ;
- dégénérative, primaire ou génétique.
Le diagnostic définitif se fera pas imagerie en coupe et/ou ponction rachidienne ou encore test génétique.
Epilepsie réactive
L’épilepsie réactive apparait suite à des anomalies toxiques (exposition à des molécules excitotoxiques comme les pyréthrinoïdes chez le chat) ou encore métaboliques ; parmi ces dernières les plus fréquentes sont l’insuffisance hépatique secondaire à une communication porto-systémique congénitale, plus rarement acquise ou fonctionnelle, des troubles calciques, l’hypoglycémie d’immaturité, d’épuisement, d’hyperinsulinisme (iatrogène ou néoplasique), des troubles ioniques.
Conclusion
Devant des crises d’épilepsie, le clinicien doit avoir une démarche rigoureuse, notamment dans la prise des commémoratifs et la conduite de son examen nerveux afin de rechercher une éventuelle cause structurelle ou fonctionnelle de l’épilepsie et de la traiter en conséquence.
> Approche des crises convulsives chez le jeune : spécificités thérapeutiques
Meaux France
I- Introduction
Ce texte se focalise principalement sur le traitement des crises convulsives chez le jeune animal. Le traitement d’autres manifestations paroxystiques plus rares, elles aussi souvent qualifiées de crises, comme la narcolepsie ou les dyskinésies paroxystiques, seront aussi abordées brièvement. Le traitement de ces manifestations peut impliquer des considérations thérapeutiques différentes par rapport à un patient adulte/plus âgé. Certaines molécules doivent être manipulées avec précautions sur les patients très jeunes (parfois quelques mois/semaines voire nouveaux nés), bien que ces mises en garde ne figurent pas toujours de façon détaillée dans les monographies/RCP. Comme souvent, l’objectif prioritaire du traitement est avant tout d’arrêter la crise, de stabiliser le patient (pouvant être plus fragile en raison de son âge), tout en prévenant la survenue de manifestations ultérieures. Dans le même temps, il est également important d’identifier rapidement la cause primaire, dans le but de mettre en place un traitement plus spécifique et d’obtenir une efficacité durable voire une guérison.
II- Arrêter les crises, utilisation des anticonvulsivants
Du fait de leurs demi-vies très courtes, il s’agit de molécules permettant une prise en charge des crises convulsives à très court terme : Interruption de la crise, prévention de la survenue d’autres crises dans les minutes/heures suivantes. Les molécules principalement utilisées dans ce contexte sont les benzodiazépines, en particulier le diazepam et le midazolam. A noter toutefois qu’il existe assez peu d’études évaluant le comportement de ces molécules chez les (très) jeunes patients. Il convient donc de les utiliser avec précaution en fonction de chaque situation, tout en respectant le principe de titration, et ce à la lumière des informations disponibles dans les RCP.
Le diazepam est généralement administré à la dose de 0,5-1mg/kg en IV stricte (ou en intra-rectal en cas d’indisponibilité de la voie veineuse). Il est préconisé d’éviter l’administration de diazepam sur les patients souffrant d’insuffisance hépatique.
Le midazolam est généralement administré à la dose de 0,2mg/kg. L’avantage de cette molécule est qu’elle peut être administrée par voie IV, IM ou même intranasale (à l’aide d’un dispositif particulier, validé par une étude récente). Les effets secondaires sont une ataxie et une sédation.
III- Prévention/réduction des crises, utilisation des antiépileptiques au long cours
Le choix de l’antiépileptique pour le traitement d'entretien doit être adapté à chaque situation. L’âge de l’animal, les antécédentsmédicaux, les potentiel effets indésirables, la nature et la gravité de la maladie sous-jacente, ainsi que les préoccupations des propriétaires doivent être pris en compte.
Lorsqu’une cause primaire aux crises est identifiée (trouble métabolique, anomalie congénitale, encéphalite…), l’utilisation d’antiépileptiques au long cours peut se faire de façon temporaire, jusqu’à résolution de la cause initiale et en plus des traitements spécifiques (cf. infra). Dans le cas d’une épilepsie idiopathique « juvénile », l’utilisation d’antiépileptiques est généralement le seul médicament à envisager (en plus d’éventuelles mesures alimentaires type NeuroCare ND), parfois pendant toute la durée de vie de l’animal. Certaines formes d’épilepsie idiopathique/bénigne juvénile disparaissent au bout de quelques mois.
Chez les animaux ayant des antécédents de crises groupées ou « clusters » (i.e. 2 crises ou plus par 24h) et/ou de status épilepticus (activité de crise prolongée), le phénobarbital est souvent utilisé en première intention, compte-tenu de son efficacité accrue par rapport à d'autres molécules. Dans ces situations, une dose de charge est généralement administrée, le plus souvent en hospitalisation. Il est important de suivre la phénobarbitalémie régulièrement, tout comme les PAL et les ALT (+/- acides biliaires/bilirubinémie en cas de suspicion d’hépatotoxicité). Chez les jeunes animaux présentant des crises moins intenses et/ou plus espacées, l’utilisation du bromure de potassium (une seule administration par jour, contre-indiquée chez le chat) ou du lévétiracétam (généralement 3 administrations par jour) peut être préférable, en raison du faible risque d'hépatotoxicité par rapport au phénobarbital. A noter que le lévétiracétam est disponible en forme injectable (ce qui peut s’avérer utile lors de dose de charge sur les patients ne pouvant pas déglutir). Le bromure est à éviter sur les patients présentant des troubles/antécédents digestifs.
Chacune de ces molécules doit bien sûr être ajustée si nécessaire, afin d’obtenir un contrôle optimal des crises ou en raison d'effets indésirables potentiels. La monothérapie est préférée en première intention, le principe de base étant d’utiliser au maximum les capacités d’une molécule. En cas d’échec de la monothérapie, il est recommandé de passer à une bi voire trithérapie. Dans tous les cas il faut informer et éduquer le propriétaire sur à la conduite à tenir, afin d’avoir son adhésion au traitement sur le long terme et ainsi optimiser les chances de succès.
IV- Traiter la cause primaire
Ne sont détaillées ci-après que la prise en charge spécifique de crises en lien avec les maladies les plus fréquemment rencontrées en pratique.
1. Spécificités des affections métaboliques
Le sujet du shunt portosystémique/encéphalose hépatique est abordé dans le détail dans les présentations des 2 modules concernant cette affection.
Chez le chat, outre les antiépileptiques, une supplémentation en vitamine B1 (+/- B12) peut être envisagée en cas de suspicion clinique (troubles neurologiques dont crises convulsives, le plus souvent dans un contexte de fugue ou d’alimentation inadaptée) ou d’éléments paracliniques en faveur d’une carence en thiamine.
2. Spécificités de l’hydrocéphalie congénitale
L’hydrocéphalie congénitale est une maladie touchant principalement les jeunes chiens des races dites toy et brachycéphales. Dans de nombreux cas, elle peut s’avérer asymptomatique et être une découverte fortuite. Il existe actuellement deux approches thérapeutiques, pouvant être utilisées successivement ou alternativement.
Le traitement médical a pour principal objectif de réduire la production de liquide cérébrospinal (LCS) et/ou d’en améliorer la résorption. L’acétazolamine, un inhibiteur de l’anhydrase carbonique, peut être donné à la dose de 10mg/kg 2 à 3 fois par jour. Il convient de surveiller le ionogramme en raison du risque d’hypokaliémie. Les glucocorticoïdes sont souvent utilisés dans le contexte d’une hydrocéphalie congénitale (prednisolone à 0,5mg/kg/j, puis diminuée jusqu’à obtenir la dose minimale efficace), en réduisant la production de LCS. Ils peuvent également apporter un bénéfice relatif en cas d’œdème périventiculaire. A noter qu’il est mentionné dans le RCP de médicaments renfermant de la prednisolone que son utilisation peut induire un retard de croissance chez les jeunes animaux. Il a été montré récemment que l’utilisation de l’oméprazole (souvent cité dans la prise en charge de cette maladie) n’avait que peu voire pas d’effet sur la production de LCS.
Le traitement chirurgical peut être envisagé dans plusieurs situations : i) dégradation malgré un traitement médical précoce etadapté, ii) présence d’une épaisseur minimale de parenchyme cérébral viable/fonctionnel, iii) absence de sepsis, de péritoniteou d’infection cutanée sur les zones d’intérêt. Ce traitement consiste en un drainage du LCS excédentaire depuis un ventricule latéral vers la cavité abdominale, via un cathéter placé en sous cutané. Des complications sont rapportées dans environ 20% des cas (la plupart du temps dans les 3 premiers mois post opératoire) : Infections, obstruction du cathéter, douleurs, hémorragies cérébrales liées à un mauvais réglage de la pression à l’intérieur du dispositif.
Il n’existe pas, à l’heure actuelle, d’étude rigoureuse comparant le traitement médical et le traitement chirurgical. La décision thérapeutique est donc à évaluer au cas par cas.
3. Spécificités des méningoencéphalites d’origine inconnue/immunitaire.
Il s’agit d’un groupe de maladies relativement hétérogènes sur le plan histologique. Bien que la cause exacte de ces maladies ne soit pas parfaitement connue, il est admis que leur origine est une inflammation d’origine immunitaire (i.e. non infectieuse) de l’encéphale. La présentation clinique varie en fonction de la localisation neuroanatomique des lésions, mais quand elles touchent le prosencéphale (i.e. cortex + thalamus), il est fréquent d’observer des crises convulsives. Ces maladies concernent principalement les petites races (Carlin, Yorkshire, Chihuahuas etc., laissant supposer une composante génétique), le plus souvent avant l’âge de 4 ans pour les formes dites nécrosantes. Ces maladies sont beaucoup plus rares chez les chats, mais existent. En plus du traitement symptomatique des crises (anticonvulsivants + antiépileptiques, cf. points précédents), il convient de mettre en place un traitement spécifique. Actuellement, ce traitement repose principalement sur l’administration de corticoïdes à doses immunosuppressives (à partir de 2-3mg/kg/j), diminuées ensuite progressivement par paliers successifs toutes les 6-8 semaines, associés à une seconde molécule immunomodulatrice. Plusieurs molécules sont utilisées, le plus souvent à la discrétion du clinicien et/ou en fonction de contraintes financières/disponibilité, sans supériorité avérée de l’une sur l’autre : cytosine arabinoside en injectable (en IV et/ou en SC, nécessitant théoriquement une hospitalisation), ciclosporine (autour de 5mg/kg/12h), azathioprine (2mg/kg/j), et de façon plus anecdotique le mycophénolate ou la lomustine. Il n’existe pas non plus, à l’heure actuelle, d’étude rigoureuse comparant l’efficacité des corticoïdes seuls versus corticoïdes + autre molécule. Le RCP du Cyclavance N.D. (cyclosporine) précise qu’il ne faut pas utiliser ce médicament chez les chiens de moins de 6 mois ni sur les animaux souffrant d’insuffisance rénale grave. L’utilisation d’azathioprine n’est pas conseillée chez le chat, et avec prudence en cas d’insuffisance rénale ou hépatique. Il convient de surveiller régulièrement la NFS.
4. Spécificité des affections dégénératives et autres malformations congénitales
Les maladies dégénératives touchant le prosencéphale comme les maladies de surcharge lysosomale (en particulier les lipofuscinoses céroides neuronales) se déclarent la plupart du temps chez des chiens de moins d’un an. La majorité de ces maladies provoque des crises convulsives, généralement après des déficits visuels et des troubles comportementaux. Le traitement est uniquement symptomatique, de manière à limiter la survenue de crises (antiépileptiques). Il n’existe pas de traitement pour ces maladies, le pronostic est mauvais, du fait d’une dégradation relativement rapide (sur plusieurs mois à un an).
D’autres malformations comme les méningocele ou méningoencéphalocele sont souvent à l’origine de crises convulsives. Ces malformations correspondent à une protrusion, respectivement des méninges seules et de l’encéphale + méninges, le plus souvent dans les cavités nasales, à travers un defect de la lame criblée. Bien que l’on puisse être tenté de corriger cette anomalie chirurgicalement, une étude récente a montré de bons résultats avec un traitement médical (antiépileptiques + corticoïdes).
5. Cas des dyskinésies paroxystiques
Il a été montré que certaines dyskinésies paroxystiques (maladies inclues dans les « troubles du mouvement ») pouvaient être liées à une intolérance au gluten, notamment chez les Border terriers. Une alimentation adaptée, réduite gluten, peut alors être envisagée dans ces contextes particuliers. Cela permet une réduction significative des symptômes, dont la fréquence des manifestations dyskinésiques.
